
原子吸收光谱(Atomic Absorption Spectroscopy, AAS)作为现代化学分析中一项至关重要的定量检测技术,其系统化发展与广泛应用可追溯至1955年。那一年,兰开夏出生的物理学家艾伦•沃尔什(Alan Walsh)在澳大利亚墨尔本的联邦科学与工业研究组织(CSIRO)发表了一篇奠基性论文,深刻阐述了原子吸收光谱的理论基础与实际潜力,为其后续发展指明了方向。
沃尔什的关键突破在于实现了分析思维的根本转变:他意识到应通过测量基态原子对特征辐射的吸收程度,而非依赖传统发射光谱中激发态原子的发光强度,来进行元素定量分析。在这一原理基础上,他系统论证了原子吸收光谱高灵敏度、高选择性和抗干扰能力强的显著优势。
基于沃尔什的开创性工作,原子吸收光谱迅速从理论走向实践。1960年代,第一批商用原子吸收光谱仪问世,标志着该技术正式进入分析实验室。这些早期仪器虽结构相对简单,但已能够可靠地测定样品中微量乃至痕量金属元素的含量,迅速引起化学、冶金、环境及临床检测等领域的高度重视。
如今,AAS已成为全球范围内元素分析的标准方法之一,广泛用于环境监测、食品安全、药品质量控制及地质勘探等多个领域。沃尔什的远见与贡献不仅革新了分析光谱学的技术体系,也真正实现了“将光谱原理转化为解决实际问题的强大工具”,成为二十世纪分析科学中最具影响力的里程碑之一。 氢的吸收光谱原理示意
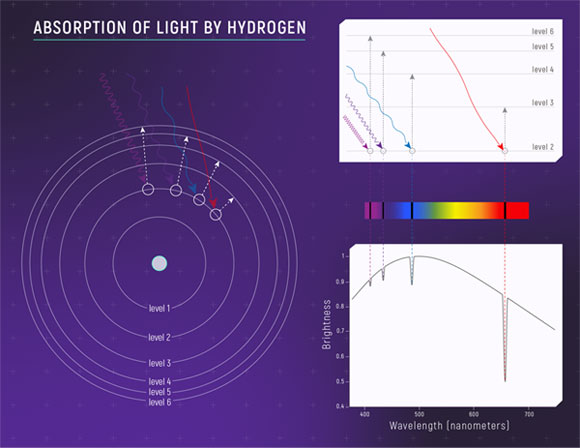
当一束白光穿过含有氢气的样品时,一件非常精妙的事情发生了:氢原子会“吃掉”其中特定颜色的光,用来把自己的电子从较低的能级“推”到更高的能级上。 如果我们让这束透过氢气的光再穿过一个棱镜展开成彩虹般连续的光谱,就会在原本连续的彩带上发现几条黑色的细线。这些黑线就像是氢原子的“指纹”,出现在非常特定的位置,比如410纳米(蓝紫色)、434纳米(蓝色)、468纳米(蓝绿色)和656纳米(红色)。它们出现的原因是,氢原子正好吸收了这些对应波长的光,使得它们无法穿过样品。 这些波长其实对应着氢原子内部电子跳跃的固定规则:都是从第二能级(level=2)跳跃至更高能级(level =3,4,5,6)所需要的能量。反过来,当电子从高能级跳回低能级时,氢原子便会发射出同样波长的光。 正因为每种元素的原子结构独一无二,它们吸收和发射的光谱也完全不同。吸收光谱中的黑线 pattern 和发射光谱中的亮线 pattern 就像是同一枚硬币的两面——它们彼此互补,共同构成了识别元素的可靠“身份证”。这也成为天文学家分析遥远恒星成分、化学家鉴定物质种类的强大工具。